Pembentukan Logam
HERI NURYANTO
Keep smile with your problem,,
Rabu, 20 Agustus 2014
Kamis, 03 April 2014
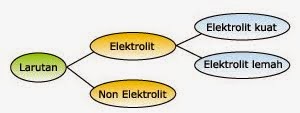
LARUTAN ELEKTROLIT
Larutan adalah campuran yang bersifat homogen atau serba sama. Jika 2
sendok makan gula putih (pasir) dilarutkan ke dalam segelas air, maka
akan didapatkan larutan gula. Larutan dapat dikelompokkan atas larutan
elektrolit dan larutan non-elektrolit. Sedangkan elektrolit dapat
dikelompokkan menjadi larutan elektrolit kuat dan elektrolit lemah.
Larutan Elektrolit ialah larutan yang dapat menghantarkan listrik karena didalamnya mengandung Ion.
Larutan Elektrolit
Larutan elektrolit merupakan larutan yang dibentuk dari zat elektrolit. Sedangkan zat elektrolit itu sendiri merupakan zat-zat yang di dalam air terurai membentuk ion-ionnya. Zat elektrolit yang terurai sempurna di dalam air disebut elektrolit kuat dan larutan yang dibentuknya disebut larutan elektrolit kuat. Zat elektrolit yang hanya terurai sebagian membentuk ion-ionnya di dalam air disebut elektrolit lemah dan larutan yang dibentuknya disebut larutan elektrolit lemah.
Larutan Non-Elektrolit
Larutan non elektrolit merupakan larutan yang dibentuk dari zat non elektrolit. Sedangkan zat non elektrolit itu sendiri merupakan zat-zat yang di dalam air tidak terurai dalam bentuk ion-ionnya, tetapi terurai dalam bentuk molekuler.
Membedakan Larutan Elektrolit dan Larutan Non Elektrolit
Larutan elektrolit dan non elektrolit dapat dibedakan dengan jelas dari sifatnya yaitu kemampuan menghantarkan listrik.
a) Larutan elektrolit dapat menghantarkan listrik.
Hal ini untuk pertama kalinya diterangkan oleh Svante August Arrhenius (1859-1927), seorang ilmuwan dari Swedia. Arrhenius menemukan bahwa zat elektrolit dalam air akan terurai menjadi partikel-partikel berupa atom atau gugus atom yang bermuatan listrik. Karena secara total larutan tidak bermuatan, maka jumlah muatan positif dalam larutan harus sama dengan muatan negatif.
Atom atau gugus atom yang bermuatan listrik itu dinamai ion. Ion yang bemuatan positif disebut kation, sedangkan ion yang bermuatan negatif disebut anion. Pembuktian sifat larutan elektrolit yang dapat menghantarkan listrik ini dapat diperlihatkan melalui eksperimen. Zat-zat yang tergolong elektrolit yaitu asam, basa, dan garam. Contoh larutan elektrolit kuat : HCl, HBr, HI, HNO3, dan lain-lain. Contoh larutan elektrolit lemah : CH3COOH, Al(OH)3 dan Na2CO3.
b) Larutan non elektrolit tidak dapat menghantarkan listrik.
Adapun larutan non elektrolit terdiri atas zat-zat non elektrolit yang tidak dilarutkan ke dalam air tidak terurai menjadi ion (tidak terionisasi). Dalam larutan, mereka tetap berupa molekul yang tidak bermuatan listrik. Itulah sebabnya larutan non elektrolit tidak dapat menghantarkan listrik. Pembuktian sifat larutan non elektrolit yang tidak dapat menghantarkan listrik ini dapat diperlihatkan melalui eksperimen. Contoh larutan non elektrolit: Larutan Gula (C12H22O11), Etanol (C2H5OH), Urea (CO(NH2)2), Glukosa (C6H12O6), dan lain-lain.
1.4 Kekuatan Elektrolit
Kekuatan suatu elektrolit ditandai dengan suatu besaran yang disebut derajat ionisasi (α)
Keterangan :
Elektrolit kuat memiliki harga α = 1, sebab semua zat yang dilarutkan terurai menjadi ion
Elektrolit lemah memiliki harga α<1, sebab hanya sebagian yang terurai menjadi ion.
Adapun non elektrolit memiliki harga α = 0, sebab tidak ada yang terurai menjadi ion.
Larutan yang dapat memberikan lampu terang, gelembung gasnya banyak, maka laurtan ini merupakan elektrolit kuat. Umumnya elektrolit kuat adalah larutan garam. Dalam proses ionisasinya, elektrolit kuat menghasilkan banyak ion maka α = 1 (terurai seluruhnya), pada persamaan reaksi ionisasi elektrolit kuat ditandai dengan anak panah satu arah ke kanan. Perlu diketahui pula elektrolit kuat ada beberapa dari asam dan basa.
Contoh :
Kation : Na+, L+, K+, Mg2+, Ca2+, Sr2+, Ba2+, NH4+
Anion : Cl‑, Br-, I-, SO42-, NO3-, ClO4 -, HSO4 -, CO3 2-, HCO3 -
Cobalah kamu buatkan 5 macam garam lengkap dengan reaksi ionisasinya sesuai dengan kation dan anion pembentuknya seperti di bawah ini.
Reaksi Ionisasi Elektrolit Lemah
Larutan yang dapat memberikan nyala redup ataupun tidak menyala, tetapi masih terdapat gelembung gas pada elektrodanya maka larutan ini merupakan elekrtolit lemah. Daya hantarnya buruk dan memiliki α (derajat ionisasi) kecil, karena sedikit larutan yang terurai (terionisasi). Makin sedikit yang terionisasi, makin lemah elektrolit tersebut. Dalam persamaan reaksi ionisasi elektrolit lemah ditandai dengan panah dua arah (bolak-balik) artinya tidak semua molekul terurai (ionisasi tidak sempurna)
Contoh:
Jenis-jenis larutan berserta sifatnya sebagai kesimpulan dari penjelasan di atas diperlihatkan pada Tabel 1.1
Tabel 1.1: Perbedaan sifat larutan elektrolit kuat, elektrolit lemah dan non elektrolit
CARA LARUTAN ELEKTROLIT MENGHANTARKAN ARUS LISTRIK
Pada tahun 1884, Svante Arrhenius, ahli kimia terkenal dari Swedia mengemukakan teori elektrolit yang sampai saat ini teori tersebut tetap bertahan padahal ia hampir saja tidak diberikan gelar doktornya di Universitas Upsala, Swedia, karena mengungkapkan teori ini. Menurut Arrhenius, larutan elektrolit dalam air terdisosiasi ke dalam partikel-partikel bermuatan listrik positif dan negatif yang disebut ion (ion positif dan ion negatif). Jumlah muatan ion positif akan sama dengan jumlah muatan ion negatif, sehingga muatan ion-ion dalam larutan netral. Ion-ion inilah yang bertugas menghantarkan arus listrik, seperti diperlihatkan pada Gambar 1.3.
Larutan yang dapat menghantarkan arus listrik disebut larutan elektrolit. Larutan ini memberikan gejala berupa menyalanya lampu atau timbulnya gelembung gas dalam larutan. Larutan elektrolit mengandung partikel-partikel yang bermuatan (kation dan anion).
Berdasarkan percobaan yang dilakukan oleh Michael Faraday, diketahui
bahwa jika arus listrik dialirkan ke dalam larutan elektrolit akan
terjadi proses elektrolisis yang menghasilkan gas. Gelembung gas ini
terbentuk karena ion positif mengalami reaksi reduksi dan ion negatif
mengalami oksidasi. Contoh, pada larutan HCl terjadi reaksi elektrolisis
yang menghasilkan gas hidrogen sebagai berikut.
HCl(aq) → H+(aq) + Cl - (aq)
Reaksi reduksi : 2H+(aq) + 2e- → H2 (g)
Reaksi oksidasi : 2Cl - (aq) → Cl2(g) + 2e-
Larutan elektrolit terdiri dari larutan elektrolit kuat contohnya HCl, H2SO4, dan larutan elektrolit lemah contohnya CH3COOH, NH3, H2S. Larutan elektrolit dapat bersumber dari senyawa ion (senyawa yang mempunyai ikatan ion) atau senyawa kovalen polar (senyawa yang mempunyai ikatan kovalen polar). Zat elektrolit yang terurai dalam air menjadi ion-ion . Beberapa contoh zat elektrolit tersebut adalah sebagai berikut:
NaCl (aq) → Na+ (aq) + Cl- (aq)
HCl (aq) → H+ (aq) + Cl- (aq)
H2SO4 (aq) → 2 H+ (aq) + SO4 2- (aq)
NaOH (aq) → Na+ (aq) + OH- (aq)
CH3COOH (aq ) → CH3COO - (aq) + H+ (aq)
Zat non elektrolit yang tidak terurai menjadi ion-ion, tapi tetap berupa molekul. Contohnya:
C2H5OH (l) → C2H5OH (aq)
CO(NH2)2 (s) → CO(NH2)2 (aq)
HUBUNGAN KEELEKTROLITAN DENGAN IKATAN KIMIA
Senyawa Ion
Sebagai contoh dari kegiatan percobaan yang tergolong larutan elektrolit yang berikatan ion adalah garam dapur. Dapatkah Anda membedakan daya hantar listrik untuk garam pada saat kristal, lelehan dan larutan? Cobalah perhatikan uraian berikut. NaCl adalah senyawa ion, jika dalam keadaan kristal sudah sebagai ion-ion, tetapi ion-ion itu terikat satu sama lain dengan rapat dan kuat, sehingga tidak bebas bergerak. Jadi dalam keadaan kristal (padatan) senyawa ion tidak dapat menghantarkan listrik, tetapi jika garam yang berikatan ion tersebut dalam keadaan lelehan atau larutan, maka ion-ionnya akan bergerak bebas, sehingga dapat menghantarkan listrik. Pada saat senyawa NaCl dilarutkan dalam air, ion-ion yang tersusun rapat dan terikat akan tertarik oleh molekul-molekul air dan air akan menyusup di sela-sela butir-butir ion tersebut (proses hidrasi) yang akhirnya akan terlepas satu sama lain dan bergerak bebas dalam larutan seperti diperlihatkan pada Gambar 1.4.
Reaksi pelarutan NaCl padat di dalam air meghasilkan ion-ion Na+ dan ion-ion Cl - yang masing-masing berikatan dengan molekul-molekul air.
NaCl (s) + air à Na+ (aq) + Cl-(aq)
Senyawa kovalen terbagi atas:
Kalau kita perhatikan, bahwa HCl merupakan senyawa kovalen diatomik yang bersifat polar, pasangan elektron ikatan tertarik ke atom Cl yang lebih elektronegatif dibanding dengan atom H. Akibatnya pada HCl, atom H lebih positif dan atom Cl lebih negatif.
Reaksi ionisasinya adalah sebagai berikut :
Larutan Elektrolit ialah larutan yang dapat menghantarkan listrik karena didalamnya mengandung Ion.
Sedangkan larutan Non Elektrolit ialah larutan
yang tidak dapat menghantarkan listrik karena didalamnya tidak mengandung Ion.
Perbedaan Larutan Elektrolit dan Non
Elektrolit
No
|
Larutan Elektrolit
|
Larutan Non Elektrolit
|
1.
|
Mengandung Ion
|
Tidak Mengandung Ion
|
2.
|
Dapat menghantarkan Listrik (Konduktor)
|
Tidak dapat Menghantarkan Listrik (Isolator)
|
3.
|
Mempunyai Kutub (Polar)
|
Tidak mempunyai Kutub (Non Polar)
|
4.
|
Jika di tes dengan alat Elektrolit tester,
maka akan menghasilkan Gelembung gas dan lampu menyala dengan terang
|
Jika di tes dengan alat Elektrolit tester,
tidak ada Gelembung gas dan lampu tidak menyala
|
5.
|
Zat Terlarutnya dapat terIonisasi
|
Zat terlarutnya tidak dapat terIonisasi
|
6.
|
a=1 atau 0<a<1
|
a=0
|
Contoh Larutan Elektrolit:
H2SO4 = Asam Sulfat
NaCl = Natrium Klorida
KOH = Kalium Hidroksida
CH3COOH = Cuka (Asam Asetat)
HCl = Asam Klorida
Contoh Larutan Non Elektrolit:
NH3 = Amoniak
CO(NH2)2 = Urea
C12H22O11 = Sukrosa
C2H5OH = Alkohol (Etanol)
CH3OH = Alkohol (Metanol)
Larutan Elektrolit Kuat&Elektrolit Lemah
Larutan Elektrolit Kuat ialah larutan yang
daya hantar listrik nya baik/kuat karena zat terlarutnya teIonisasi sempurna.
Larutan Elektrolit Lemah ialah larutan yang
daya hantar listrik nya kurang baik/lemaht karena zat terlarutnya teIonisasi
sebagian.
No
|
Larutan Elektrolit Kuat
|
Larutan Elektrolit Lemah
|
1.
|
a=1
|
a=0<a<1
|
2.
|
Terionisasi Sempurna
|
Terionisasi Sebagian
|
3.
|
Daya Hantar Listriknya Baik (Kuat)
|
Daya hantar Listriknya Kurang Baik (Lemah)
|
4.
|
Jumlah Ion nya banyak
|
Jumlah Ion nya sedikit
|
5.
|
Jika di tes dengan alat Elektrolit tester,
maka akan menghasilkan Gelembung gas dan lampu menyala dengan terang
|
Jika di tes dengan alat Elektrolit tester,
maka akan menghasilkan Gelembung gas tetapi lampu redup/tidak menyala
|
Contoh Larutan Elektrolit Kuat:
H2SO4 = Asam Sulfat
NaCl = Natrium Klorida
KOH = Kalium Hidroksida
HCl = Asam Klorida
Contoh Larutan Elektrolit Lemah:
CH3COOH = Cuka (Asam Asetat)
Larutan Elektrolit
Larutan elektrolit merupakan larutan yang dibentuk dari zat elektrolit. Sedangkan zat elektrolit itu sendiri merupakan zat-zat yang di dalam air terurai membentuk ion-ionnya. Zat elektrolit yang terurai sempurna di dalam air disebut elektrolit kuat dan larutan yang dibentuknya disebut larutan elektrolit kuat. Zat elektrolit yang hanya terurai sebagian membentuk ion-ionnya di dalam air disebut elektrolit lemah dan larutan yang dibentuknya disebut larutan elektrolit lemah.
Larutan Non-Elektrolit
Larutan non elektrolit merupakan larutan yang dibentuk dari zat non elektrolit. Sedangkan zat non elektrolit itu sendiri merupakan zat-zat yang di dalam air tidak terurai dalam bentuk ion-ionnya, tetapi terurai dalam bentuk molekuler.
Membedakan Larutan Elektrolit dan Larutan Non Elektrolit
Larutan elektrolit dan non elektrolit dapat dibedakan dengan jelas dari sifatnya yaitu kemampuan menghantarkan listrik.
a) Larutan elektrolit dapat menghantarkan listrik.
Hal ini untuk pertama kalinya diterangkan oleh Svante August Arrhenius (1859-1927), seorang ilmuwan dari Swedia. Arrhenius menemukan bahwa zat elektrolit dalam air akan terurai menjadi partikel-partikel berupa atom atau gugus atom yang bermuatan listrik. Karena secara total larutan tidak bermuatan, maka jumlah muatan positif dalam larutan harus sama dengan muatan negatif.
Atom atau gugus atom yang bermuatan listrik itu dinamai ion. Ion yang bemuatan positif disebut kation, sedangkan ion yang bermuatan negatif disebut anion. Pembuktian sifat larutan elektrolit yang dapat menghantarkan listrik ini dapat diperlihatkan melalui eksperimen. Zat-zat yang tergolong elektrolit yaitu asam, basa, dan garam. Contoh larutan elektrolit kuat : HCl, HBr, HI, HNO3, dan lain-lain. Contoh larutan elektrolit lemah : CH3COOH, Al(OH)3 dan Na2CO3.
b) Larutan non elektrolit tidak dapat menghantarkan listrik.
Adapun larutan non elektrolit terdiri atas zat-zat non elektrolit yang tidak dilarutkan ke dalam air tidak terurai menjadi ion (tidak terionisasi). Dalam larutan, mereka tetap berupa molekul yang tidak bermuatan listrik. Itulah sebabnya larutan non elektrolit tidak dapat menghantarkan listrik. Pembuktian sifat larutan non elektrolit yang tidak dapat menghantarkan listrik ini dapat diperlihatkan melalui eksperimen. Contoh larutan non elektrolit: Larutan Gula (C12H22O11), Etanol (C2H5OH), Urea (CO(NH2)2), Glukosa (C6H12O6), dan lain-lain.
1.4 Kekuatan Elektrolit
Kekuatan suatu elektrolit ditandai dengan suatu besaran yang disebut derajat ionisasi (α)
Keterangan :
Elektrolit kuat memiliki harga α = 1, sebab semua zat yang dilarutkan terurai menjadi ion
Elektrolit lemah memiliki harga α<1, sebab hanya sebagian yang terurai menjadi ion.
Adapun non elektrolit memiliki harga α = 0, sebab tidak ada yang terurai menjadi ion.
- Elektrolit kuat : α = 1(terionisasi sempurna)
- Elektrolit lemah : 0 < α < 1 (terionisasi sebagian)
- Non Elektrolit : α = 0 (tidak terionisasi)
Larutan yang dapat memberikan lampu terang, gelembung gasnya banyak, maka laurtan ini merupakan elektrolit kuat. Umumnya elektrolit kuat adalah larutan garam. Dalam proses ionisasinya, elektrolit kuat menghasilkan banyak ion maka α = 1 (terurai seluruhnya), pada persamaan reaksi ionisasi elektrolit kuat ditandai dengan anak panah satu arah ke kanan. Perlu diketahui pula elektrolit kuat ada beberapa dari asam dan basa.
Contoh :
- NaCl (aq) à Na+(aq) + Cl-(aq)
- KI (aq) à K+ (aq) + I - (aq)
- Ca(NO3)2 (g) à Ca 2+ (aq) + 2NO3 - (aq)
Kation : Na+, L+, K+, Mg2+, Ca2+, Sr2+, Ba2+, NH4+
Anion : Cl‑, Br-, I-, SO42-, NO3-, ClO4 -, HSO4 -, CO3 2-, HCO3 -
Cobalah kamu buatkan 5 macam garam lengkap dengan reaksi ionisasinya sesuai dengan kation dan anion pembentuknya seperti di bawah ini.
No
|
Kation
|
Anion
|
Reaksi Ionisasi
|
Garam
|
| 1 | Mg2+ | Br - | ||
| 2 | Ca2+ | ClO4 - | ||
| 3 | NH4+ | Cl - | ||
| 4 | Mg2+ | Br - | ||
| 5 | Ca2+ | ClO4 - | ||
| 6 | Ba2+ | NO3 - | ||
| 7 | Na+ | SO42- |
Larutan yang dapat memberikan nyala redup ataupun tidak menyala, tetapi masih terdapat gelembung gas pada elektrodanya maka larutan ini merupakan elekrtolit lemah. Daya hantarnya buruk dan memiliki α (derajat ionisasi) kecil, karena sedikit larutan yang terurai (terionisasi). Makin sedikit yang terionisasi, makin lemah elektrolit tersebut. Dalam persamaan reaksi ionisasi elektrolit lemah ditandai dengan panah dua arah (bolak-balik) artinya tidak semua molekul terurai (ionisasi tidak sempurna)
Contoh:
- CH3COOH (aq) » CH3COO - (aq) + H+(aq)
- NH4OH(g) » NH4+(aq) + OH - (aq)
No
|
Larutan Elektrolit Lemah
|
Reaksi Ionisasi
|
| 1. | H2S (aq) | |
| 2. | H3PO4 (aq) | |
| 3. | HF(g) | |
| 4. | HCOOH(aq) | |
| 5. | HCN(aq) |
Tabel 1.1: Perbedaan sifat larutan elektrolit kuat, elektrolit lemah dan non elektrolit
Jenis Larutan
|
Sifat dan Pengamatan Lain
|
Contoh Senyawa
|
Reaksi Ionisasi
|
| Elektrolit Kuat | - terionisasi sempurna - menghantarkan arus listrik - lampu menyala terang - terdapat gelembung gas |
NaCl, HCl, NaOH, H2SO4,KCl |
NaCl Na+ + Cl- NaOH Na+ + OH- H2SO4 2 H+ + SO42- KCl K+ + Cl- |
| Elektrolit Lemah | - terionisasi sebagian - menghantarkan arus listrik - lampu menyala redup - terdapat gelembung gas |
NH4OH, HCN, Al(OH)3 |
NH4OH NH4+ + OH- HCN H+ + CN- Al(OH)3 Al3+ + 3OH- |
| Non Elektrolit | - tidak terionisasi - tidak menghantarkan listrik - lampu tidak menyala - tidak terdapat gelembung gas |
C6H12O6, C12H22O11, CO(NH2)2 C2H5OH |
C6H12O6,C12H22O11, CO(NH2)2 C2H5OH |
Pada tahun 1884, Svante Arrhenius, ahli kimia terkenal dari Swedia mengemukakan teori elektrolit yang sampai saat ini teori tersebut tetap bertahan padahal ia hampir saja tidak diberikan gelar doktornya di Universitas Upsala, Swedia, karena mengungkapkan teori ini. Menurut Arrhenius, larutan elektrolit dalam air terdisosiasi ke dalam partikel-partikel bermuatan listrik positif dan negatif yang disebut ion (ion positif dan ion negatif). Jumlah muatan ion positif akan sama dengan jumlah muatan ion negatif, sehingga muatan ion-ion dalam larutan netral. Ion-ion inilah yang bertugas menghantarkan arus listrik, seperti diperlihatkan pada Gambar 1.3.
Larutan yang dapat menghantarkan arus listrik disebut larutan elektrolit. Larutan ini memberikan gejala berupa menyalanya lampu atau timbulnya gelembung gas dalam larutan. Larutan elektrolit mengandung partikel-partikel yang bermuatan (kation dan anion).
| Gambar 1.3 Cara larutan elektrolit menghantarkan arus listrik
Larutan elektrolit dapat menghantarkan listrik karena mengandung ion-ion yang dapat bergerak bebas. Ion-ion itulah yang menghantarkan arus listrik melalui larutan |
HCl(aq) → H+(aq) + Cl - (aq)
Reaksi reduksi : 2H+(aq) + 2e- → H2 (g)
Reaksi oksidasi : 2Cl - (aq) → Cl2(g) + 2e-
Larutan elektrolit terdiri dari larutan elektrolit kuat contohnya HCl, H2SO4, dan larutan elektrolit lemah contohnya CH3COOH, NH3, H2S. Larutan elektrolit dapat bersumber dari senyawa ion (senyawa yang mempunyai ikatan ion) atau senyawa kovalen polar (senyawa yang mempunyai ikatan kovalen polar). Zat elektrolit yang terurai dalam air menjadi ion-ion . Beberapa contoh zat elektrolit tersebut adalah sebagai berikut:
NaCl (aq) → Na+ (aq) + Cl- (aq)
HCl (aq) → H+ (aq) + Cl- (aq)
H2SO4 (aq) → 2 H+ (aq) + SO4 2- (aq)
NaOH (aq) → Na+ (aq) + OH- (aq)
CH3COOH (aq ) → CH3COO - (aq) + H+ (aq)
Zat non elektrolit yang tidak terurai menjadi ion-ion, tapi tetap berupa molekul. Contohnya:
C2H5OH (l) → C2H5OH (aq)
CO(NH2)2 (s) → CO(NH2)2 (aq)
HUBUNGAN KEELEKTROLITAN DENGAN IKATAN KIMIA
Senyawa Ion
Sebagai contoh dari kegiatan percobaan yang tergolong larutan elektrolit yang berikatan ion adalah garam dapur. Dapatkah Anda membedakan daya hantar listrik untuk garam pada saat kristal, lelehan dan larutan? Cobalah perhatikan uraian berikut. NaCl adalah senyawa ion, jika dalam keadaan kristal sudah sebagai ion-ion, tetapi ion-ion itu terikat satu sama lain dengan rapat dan kuat, sehingga tidak bebas bergerak. Jadi dalam keadaan kristal (padatan) senyawa ion tidak dapat menghantarkan listrik, tetapi jika garam yang berikatan ion tersebut dalam keadaan lelehan atau larutan, maka ion-ionnya akan bergerak bebas, sehingga dapat menghantarkan listrik. Pada saat senyawa NaCl dilarutkan dalam air, ion-ion yang tersusun rapat dan terikat akan tertarik oleh molekul-molekul air dan air akan menyusup di sela-sela butir-butir ion tersebut (proses hidrasi) yang akhirnya akan terlepas satu sama lain dan bergerak bebas dalam larutan seperti diperlihatkan pada Gambar 1.4.
Reaksi pelarutan NaCl padat di dalam air meghasilkan ion-ion Na+ dan ion-ion Cl - yang masing-masing berikatan dengan molekul-molekul air.
NaCl (s) + air à Na+ (aq) + Cl-(aq)
Gambar 1.4 Proses pelarutan NaCl padat di dalam air
3.2 Senyawa KovalenSenyawa kovalen terbagi atas:
- senyawa kovalen non polar, contoh : F2, Cl2, Br2, I2, CH4
- senyawa kovalen polar, contoh: HCl, HBr, HI, NH3.
Kalau kita perhatikan, bahwa HCl merupakan senyawa kovalen diatomik yang bersifat polar, pasangan elektron ikatan tertarik ke atom Cl yang lebih elektronegatif dibanding dengan atom H. Akibatnya pada HCl, atom H lebih positif dan atom Cl lebih negatif.
Reaksi ionisasinya adalah sebagai berikut :
HCL(aq) –> H+(aq) + Cl-(aq)
Jadi walaupun molekul HCl bukan senyawa ion, jika dilarutkan ke dalam
air maka larutannya dapat menghantarkan arus listrik karena
menghasilkan ion-ion yang bergerak bebas.
Selasa, 18 Februari 2014
Soal MIDTEST KIMIA SEMESTER GENAP
1. Atom merupakan pertikel terkecil yang tidak dapat dibagi-bagi lagi, merupakan teori atom menurut……
a. John Dalton
b. JJ. Thompson
c. Niels Bohr
d. Rutherford
e. Erwin Schrodinger
2. Model atom roti kismis diperkenalkan oleh……
a. Rutherford
b. JJ. Thompson
c. John Dalton
d. Niels Bohr
e. Erwin Schrodinger
3. Jarak dari inti atom sampe kulit terluar atom merupakan definisi dari…..
a. Energi Ionisasi
b. Jari-jari atom
c. Afinitas elektron
d. Keelektronegatifan
e. Sistem periodik unsur
4. Apa yang dimaksud dengan elektron valensi…..
a. Elektron terluar
b. Elektron yang berada pada kuliat terluar atom
c. Elektron pada kulit ke-1
d. Jawaban a, b dan c benar
e. Tidak ada jawaban yang benar
5. Dalam satu golongan afinitas elektron nilainya adalah….
a. Semakin besar
b. Semakin kecil
c. tetap
d. Jawaban a, b dan c benar
e. Tidak ada jawaban yang benar
6. Berada pada golongan berapa unsur dengan nomor atom 18…..
a. Golongan VIII A
b. Golongan VII A
c. Golongan X A
d. Golongan I A
e. Golongan II A
7. Jumlah elektron pada ion 13Al3+…..
a. 13
b. 10
c. 16
a. 2, 8, 4
b. 1s2, 2s2, 2p6, 3s2, 3p2
c. 1s2, 2s2, 2p6, 3s4
d. Semua jawaban benar
e. Jawaban a dan b benar
9. Berapa jumlah proton unsur 6C4-….
a. 2
b. 6
c. 10
d. Semua jawaban salah
e. Semua jawaban benar
10. Senyawa dengan Massa Molekul relatif yang paling besar adalah……
a. CO2
b. C6H12O6
c. CH3COOH
d. (COOH)2
e. N2H4
11. Berapa gram massa Karbon dalam 4,4 gram CO2…..
a. 3,2 gram
b. 1,2 gram
c. 12 gram
d. 0,12 gram
e. 0,32 gram
12. Berapa % kandungan hydrogen dalam H2SO4.6H2O 98 %…….
a. 6,67 %
b. 6,66 %
c. 6,65 %
d. 0,95 %
e. 3,80 %
13. 2,24 L asam asetat diukur pada keadaan standar memiliki massa 6 gram, Masa Molekul Relatif (Mr) asam asetat adalah….
a. 60
b. 120
c. 46
d. 98
e. 180
14. Berapa liter gas NO 0,01 mol jika diukur dalam keadaan standar….
a. 22,4 L
b. 2,24 L
c. 0,24 L
d. 0,224 L
e. 224 L
15. Berapa mol NH3 dengan jumlah molekul 3,01×1021…..
a. 0,5 mol
b. 5 mol
c. 0,05 mol
d. 50 mol
e. 0,005 mol
16. Berapa volume 0,01mol CH4 jika diukur pada tekanan 76 mmHg (1 atm) dan suhu 25oC, jika diketahui Tetapan Gas adalah 0,082 L atm/mol K…..
a. 0,224 L
b. 2,24 L
c. 224 L
d. 22,4 L
e. 0,0224 L
17. Berapa jumlah molekul H2O 1,8 gram(Ar H=1, Ar O=16)…..
a. 6,02 x 1023
b. 6,02 x 1022
c. 6,02 x 1021
d. 6,02 x 1020
e. 6,02 x 1019
18. Berapa masa 2 L C2H6 jika diukur pada tekanan 1 atm dan suhu 27oC jika diketahui tetapan gas (0,082 L atm/mol K)….
a. 2,7 gram
b. 27 gram
c. 0,24 gram
d. 24 gram
e. 2,4 gram
19. Massa 2,24 liter gas X2 adalah 1,8 gram, tentukan Ar X…
a. 18
b. 9
c. 27
d. 6
e. 4,5
20. Berapa jumlah atom gas hidrogen 2 liter jika diukur pada tekanan 2 atm dan suhu 27oC…
a. 0.096 x 1022
b. 0,96 x 1022
c. 9,6 x 1022
d. 6.02 x 1023
e. 6,02 x 1022
I. Uraian
Jawablah pertanyaan-pertanyaan di bawah ini dengan tepat!
1. Jelaskan mengapa jari-jari atom dalam satu golongan dari atas ke bawah semakin besar dan dari kiri ke kanan dalam satu periode semakin kecil!
2. Hitung Jumlah Proton, Neutron dan Elektron pada Unsur dan ion di bawah ini :
a.
b. 2+
c. 3+
d. 2-
e. -
3. Tentukan jumlah Massa Molekul Relatif dibawah ini :
a. CH3CH2COOH
b. C6H12O6
c. C3H7OH
d. Al2(PO4)3
e. H2SO4.6H2O
Diketahui (Ar C=12, Ar H=1, Ar O=16, Ar Al=27, Ar P=31, Ar S=32)
4. Tentukan Periode dan Golongan Unsur di bawah ini :
a. 17Cl
b. 19K
c. 16S
d. 12Mg
e. 7N
5. 1,7 gram gas Amonia (NH3) (Ar N=14, Ar H=1) direaksikan dalam keadaan standar.
Tentukan :
a. Massa N dalam Amonia!
b. Massa H dalam Amonia!
c. Mol Gas Amonia!
d. Jumlah Molekul Gas Amonia!
e. Volume Gas Amonia dalam Keadaan standar!
Volume Gas Amonia pada tekanan 2 atm dan suhu 27oC!
Jumat, 08 November 2013
Bacharuddin Jusuf Habibie
| Presiden Indonesia ke-3 | |
|---|---|
| Masa jabatan 21 Mei 1998 – 20 Oktober 1999 | |
| Wakil Presiden | Tidak ada |
| Didahului oleh | Soeharto |
| Digantikan oleh | Abdurrahman Wahid |
| Wakil Presiden Indonesia ke-7 | |
| Masa jabatan 11 Maret 1998 – 21 Mei 1998 | |
| Presiden | Soeharto |
| Didahului oleh | Try Sutrisno |
| Digantikan oleh | Megawati Sukarnoputri |
| Menteri Negara Riset dan Teknologi Republik Indonesia ke-1 | |
| Masa jabatan 29 Maret 1978 – 16 Maret 1998 | |
| Presiden | Soeharto |
| Didahului oleh | Tidak ada |
| Digantikan oleh | Rahardi Ramelan |
| Informasi pribadi | |
| Lahir | 25 Juni 1936 (umur 77) |
| Kebangsaan | |
| Partai politik | Golkar |
| Suami/istri | Hasri Ainun Habibie |
| Anak | Ilham Akbar Thareq Kemal |
| Alma mater | Institut Teknologi Bandung Rheinisch-Westfälische Technische Hochschule Aachen |
| Profesi | Insinyur |
| Agama | Islam |
LATIHAN SOAL ASAM DAN BASA
Indicator
|
Trayek
perubahan warna
|
Perubahan
warna
|
Metil
merah
Bromtimol
biru
Fenolftalein
|
4,2 – 6,3
6,0 – 7,6
8,3 – 10,0
|
Merah
– kuning
Kuning
– biru
Tak
berwarna - merah
|
a. Apa yang dimaksud dengan trayek
perubahan warna indicator?
b. Suatu larutan berwarna kuning
dengan metal merah, berwarna biru dengan bromtimol biru dan tidak berwarna
dengan fenolftalein. Berapakah pH larutan itu?
2. Hitunglah pH larutan berikut :
a. Larutan H2SO4
0,005 M
b. Larutan 3,7 gram Ca(OH)2
dalam 10 liter larutan (Mr 74)
c. Satu mL H2SO4
0,1 M dilarutkan dalam 1 liter air.
d. 1,8 mL asam sulfat pekat 98 %,
massa jenis 1,8 kg/L dilarutkan dalam 200 mL air.
3. Hitunglah pH larutan berikut :
a. Asam formiat 0,01 M, Ka= 4.10-4
b. Larutan asam cuka 0,2 M, jika
derajat ionisasi 0,01
c. Larutan amoniak (NH3
atau NH4OH) 0,001 M, Kb= 1.10-5
d. Larutan Fe(OH)3 yang
memiliki derajat ionisasi 0,003 dan Kb = 9. 10-5
4. Larutan suatu asam lemah HA 0,1 M
mempunyai pH yang sama dengan larutan HCl 0,001 M. tentukan harga Ka asam HA
tersebut!
5. Berapa mL larutan H2SO4
1 M harus ditambahkan ke dalam 500 mL akuades supaya pH-nya menjadi 3?
(perubahan volume karena penambahan larutan H2SO4 dapat
diabaikan)
Langganan:
Postingan (Atom)